3 млрд лет не прошли даром: иммунитет микробов поднимет нас на новую ступень эволюции?
NewsMakerДревние защитные системы на службе современной науки.

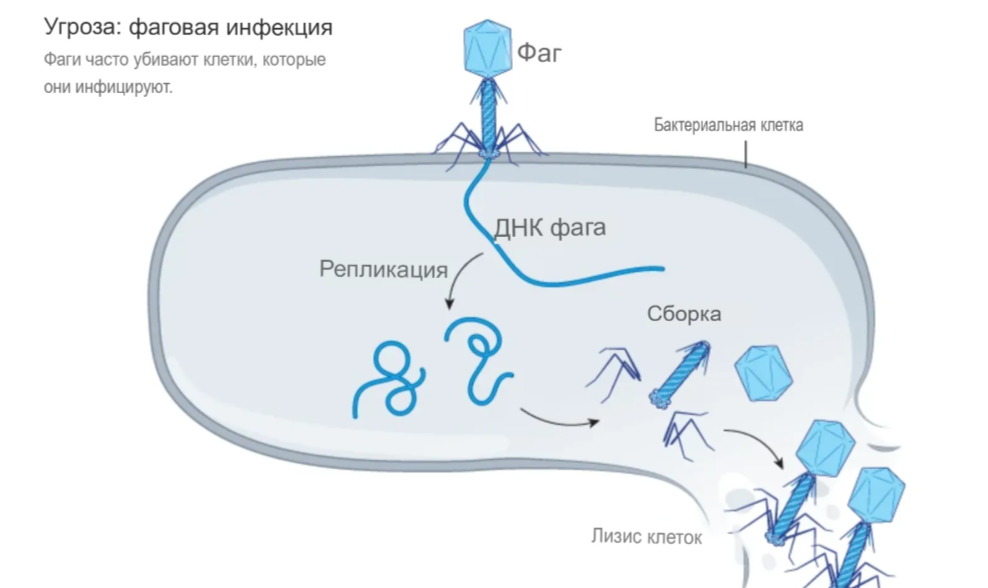
На нашей планете непрерывно разворачивается невидимая война. В океанах, почве и даже человеческом теле гигантская армия бактерий, насчитывающая около 10³⁰ особей, ведет борьбу с ещё более многочисленным противником - бактериальными вирусами, или бактериофагами. За миллиарды лет эволюции микроорганизмы выработали множество изощренных стратегий безопасности: они научились разрушать генетический материал вирусов, блокировать их размножение и даже жертвовать собой, спасая соседние клетки от заражения. В ответ вирусы постоянно совершенствуют свои стратегии нападения, что превращает это противостояние в бесконечную гонку вооружений.
Изучение древних иммунных систем уже привело к революционным открытиям в биологии. Ярким примером служит система CRISPR-Cas — универсальный инструмент редактирования генов, позаимствованный у бактерий. Механизм работает как высокоточные молекулярные ножницы: специальные белки Cas находят в ДНК вирусов определенные последовательности и разрезают их. Бактерии таким образом защищаются от врагов, а люди адаптировали их тактику для редактирования генов любых организмов. Технология оказалась настолько эффективной, что её создатели Дженнифер Дудна и Эммануэль Шарпантье получили Нобелевскую премию по химии в 2020 году .
Не менее важным стало открытие рестрикционных ферментов — бактериальных белков, способных разрезать ДНК в строго определённых местах. Обнаруженные в 1970-х годах, они заложили фундамент современной молекулярной биологии. Благодаря им стало возможным создание генетически модифицированных видов и продуктов, производство важных лекарственных белков и развитие методов ДНК-диагностики.
Успех этих технологий побудил биологов начать систематический поиск новых стратегий выживания у микроорганизмов. Прорыв произошёл в 2011 году, когда исследователи обнаружили, что гены микробного иммунитета не разбросаны хаотично по геному, а собраны в особые кластеры — "острова защиты". Это открытие предоставило нам своеобразную карту для поиска: зная расположение одного “боевого” гена, они могли с высокой вероятностью найти поблизости и другие.
Затем началась новая эра в изучении микробного иммунитета. Учёные разработали эффективную стратегию поиска защитных систем: они берут предполагаемый защитный ген, встраивают его в лабораторный штамм бактерий и проверяют, сможет ли он уберечь организм от вирусной атаки. Такой подход позволил обнаружить сотни новых генов и инструментов, многие из которых оказались неожиданно похожи на компоненты иммунной системы человека и растений.
Особый интерес представляет фаговая терапия — метод лечения бактериальных инфекций с помощью специально подобранных вирусов-бактериофагов. В отличие от антибиотиков, которые часто действуют на широкий спектр бактерий, бактериофаги атакуют только определённые виды микроорганизмов. Изучение природных механизмов противостояния бактерий и вирусов помогает создавать более эффективные терапевтические препараты и разрабатывать новые стратегии преодоления антибиотикорезистентности.
Одно из самых неожиданных открытий сделал биохимик Филип Кранцуш, изучая защитную систему под названием CBASS. Выяснилось, что бактерии используют механизм, поразительно похожий на ещё один конкретный компонент человеческого иммунитета — белок cGAS. Этот белок выступает своеобразным датчиком, который распознает чужеродную ДНК в клетке и запускает ответную реакцию. У бактерий обнаружилась не только похожая система обнаружения угрозы, но и идентичный рецептор сигнальной молекулы — белок STING. Какой может быть вывод? Вероятно, некоторые механизмы возникли у общего предка всех живых организмов и сохранились в ходе эволюции на протяжении миллиардов лет.
Дальнейшие исследования выявили ещё больше параллелей между иммунными системами разных форм жизни. У бактерий нашли аналоги белков гасдерминов, которые у человека создают поры в мембране заражённых клеток, вызывая их гибель и предотвращая распространение инфекции. Также были обнаружены бактериальные версии виперинов — белков, блокирующих размножение вирусов путём остановки синтеза вирусных белков. А система под названием Thoeris оказалась удивительно похожа на механизмы противовирусной борьбы растений.
Современные технологии позволяют не только находить новые защитные комплексы, но и адаптировать их для практического применения. Например, система редактирования генетического материала, названная AGN (от англ. Argonaute), использует короткие молекулы РНК для поиска и модификации определённых участков ДНК. В отличие от CRISPR-Cas, она не требует специальных последовательностей для распознавания цели, что делает её более гибким инструментом для генной инженерии. AGN уже применяют для создания диагностических тестов, которые меняют цвет или начинают светиться при обнаружении специфических последовательностей нуклеотидов.
Ещё одним перспективным направлением стало изучение ретронов — особых генетических элементов, впервые обнаруженных у почвенных бактерий. Эти элементы содержат фермент обратную транскриптазу, способную создавать ДНК на основе РНК-матрицы. Долгое время их функция оставалась загадкой, пока в 2020 году не выяснилось, что ретроны входят в состав оборонительной системы типа "токсин-антитоксин". При обнаружении вирусной угрозы они запускают механизм самоуничтожения клетки, предотвращая распространение патогена.
Параллельно разрабатывают новую систему редактирования генов TIGR-Tas, которая, подобно CRISPR, может точно находить и модифицировать определённые участки ДНК. Её преимущество заключается в меньшем размере компонентов, что особенно важно для применения в генной терапии, где количество генетического материала, которое можно доставить в клетки, строго ограничено.
Растущее понимание разнообразия микробных защитных систем открывает широкие перспективы для биотехнологии и медицины. Исследователи учатся использовать эти механизмы, чтобы контролировать промышленно важные штаммы бактерий в биореакторах, создания новых методов диагностики заболеваний и разработки более эффективных способов генной терапии.
Особое внимание привлекает возможность комбинирования различных подходов. Предполагается, что объединение нескольких механизмов может создать более надёжные инструменты для генной инженерии. Нетрудно представить, как далеко мы продвинемся, если сможем сочетать в терапии точность CRISPR-Cas с компактностью TIGR-Tas или универсальностью AGN.
Накопленные знания о микробных иммунных системах также помогают в борьбе с устойчивостью бактерий к антибиотикам — одной из самых серьёзных угроз современной медицины. В частности, фаговая терапия, основанная на использовании естественных врагов бактерий, становится всё более перспективной альтернативой традиционным антибиотикам.

На нашей планете непрерывно разворачивается невидимая война. В океанах, почве и даже человеческом теле гигантская армия бактерий, насчитывающая около 10³⁰ особей, ведет борьбу с ещё более многочисленным противником - бактериальными вирусами, или бактериофагами. За миллиарды лет эволюции микроорганизмы выработали множество изощренных стратегий безопасности: они научились разрушать генетический материал вирусов, блокировать их размножение и даже жертвовать собой, спасая соседние клетки от заражения. В ответ вирусы постоянно совершенствуют свои стратегии нападения, что превращает это противостояние в бесконечную гонку вооружений.
Изучение древних иммунных систем уже привело к революционным открытиям в биологии. Ярким примером служит система CRISPR-Cas — универсальный инструмент редактирования генов, позаимствованный у бактерий. Механизм работает как высокоточные молекулярные ножницы: специальные белки Cas находят в ДНК вирусов определенные последовательности и разрезают их. Бактерии таким образом защищаются от врагов, а люди адаптировали их тактику для редактирования генов любых организмов. Технология оказалась настолько эффективной, что её создатели Дженнифер Дудна и Эммануэль Шарпантье получили Нобелевскую премию по химии в 2020 году .
Не менее важным стало открытие рестрикционных ферментов — бактериальных белков, способных разрезать ДНК в строго определённых местах. Обнаруженные в 1970-х годах, они заложили фундамент современной молекулярной биологии. Благодаря им стало возможным создание генетически модифицированных видов и продуктов, производство важных лекарственных белков и развитие методов ДНК-диагностики.
Успех этих технологий побудил биологов начать систематический поиск новых стратегий выживания у микроорганизмов. Прорыв произошёл в 2011 году, когда исследователи обнаружили, что гены микробного иммунитета не разбросаны хаотично по геному, а собраны в особые кластеры — "острова защиты". Это открытие предоставило нам своеобразную карту для поиска: зная расположение одного “боевого” гена, они могли с высокой вероятностью найти поблизости и другие.
Затем началась новая эра в изучении микробного иммунитета. Учёные разработали эффективную стратегию поиска защитных систем: они берут предполагаемый защитный ген, встраивают его в лабораторный штамм бактерий и проверяют, сможет ли он уберечь организм от вирусной атаки. Такой подход позволил обнаружить сотни новых генов и инструментов, многие из которых оказались неожиданно похожи на компоненты иммунной системы человека и растений.
Особый интерес представляет фаговая терапия — метод лечения бактериальных инфекций с помощью специально подобранных вирусов-бактериофагов. В отличие от антибиотиков, которые часто действуют на широкий спектр бактерий, бактериофаги атакуют только определённые виды микроорганизмов. Изучение природных механизмов противостояния бактерий и вирусов помогает создавать более эффективные терапевтические препараты и разрабатывать новые стратегии преодоления антибиотикорезистентности.

Одно из самых неожиданных открытий сделал биохимик Филип Кранцуш, изучая защитную систему под названием CBASS. Выяснилось, что бактерии используют механизм, поразительно похожий на ещё один конкретный компонент человеческого иммунитета — белок cGAS. Этот белок выступает своеобразным датчиком, который распознает чужеродную ДНК в клетке и запускает ответную реакцию. У бактерий обнаружилась не только похожая система обнаружения угрозы, но и идентичный рецептор сигнальной молекулы — белок STING. Какой может быть вывод? Вероятно, некоторые механизмы возникли у общего предка всех живых организмов и сохранились в ходе эволюции на протяжении миллиардов лет.
Дальнейшие исследования выявили ещё больше параллелей между иммунными системами разных форм жизни. У бактерий нашли аналоги белков гасдерминов, которые у человека создают поры в мембране заражённых клеток, вызывая их гибель и предотвращая распространение инфекции. Также были обнаружены бактериальные версии виперинов — белков, блокирующих размножение вирусов путём остановки синтеза вирусных белков. А система под названием Thoeris оказалась удивительно похожа на механизмы противовирусной борьбы растений.
Современные технологии позволяют не только находить новые защитные комплексы, но и адаптировать их для практического применения. Например, система редактирования генетического материала, названная AGN (от англ. Argonaute), использует короткие молекулы РНК для поиска и модификации определённых участков ДНК. В отличие от CRISPR-Cas, она не требует специальных последовательностей для распознавания цели, что делает её более гибким инструментом для генной инженерии. AGN уже применяют для создания диагностических тестов, которые меняют цвет или начинают светиться при обнаружении специфических последовательностей нуклеотидов.
Ещё одним перспективным направлением стало изучение ретронов — особых генетических элементов, впервые обнаруженных у почвенных бактерий. Эти элементы содержат фермент обратную транскриптазу, способную создавать ДНК на основе РНК-матрицы. Долгое время их функция оставалась загадкой, пока в 2020 году не выяснилось, что ретроны входят в состав оборонительной системы типа "токсин-антитоксин". При обнаружении вирусной угрозы они запускают механизм самоуничтожения клетки, предотвращая распространение патогена.
Параллельно разрабатывают новую систему редактирования генов TIGR-Tas, которая, подобно CRISPR, может точно находить и модифицировать определённые участки ДНК. Её преимущество заключается в меньшем размере компонентов, что особенно важно для применения в генной терапии, где количество генетического материала, которое можно доставить в клетки, строго ограничено.
Растущее понимание разнообразия микробных защитных систем открывает широкие перспективы для биотехнологии и медицины. Исследователи учатся использовать эти механизмы, чтобы контролировать промышленно важные штаммы бактерий в биореакторах, создания новых методов диагностики заболеваний и разработки более эффективных способов генной терапии.
Особое внимание привлекает возможность комбинирования различных подходов. Предполагается, что объединение нескольких механизмов может создать более надёжные инструменты для генной инженерии. Нетрудно представить, как далеко мы продвинемся, если сможем сочетать в терапии точность CRISPR-Cas с компактностью TIGR-Tas или универсальностью AGN.
Накопленные знания о микробных иммунных системах также помогают в борьбе с устойчивостью бактерий к антибиотикам — одной из самых серьёзных угроз современной медицины. В частности, фаговая терапия, основанная на использовании естественных врагов бактерий, становится всё более перспективной альтернативой традиционным антибиотикам.